Ribosom
Organyn mewn celloedd organebau byw yw'r ribosom[1]. Mae'n creu holl broteinau bywyd trwy'r broses o drosiad gan ddefnyddio gwybodaeth enetig DNA trwy gyfrwng molecylau RNA.
Cefndir
[golygu | golygu cod]Darganfuwyd y ribosom yn y 1950au gan George Emil Palade, fiolegydd y gell o Rufain. Trwy ddefnyddio meicrosgop electron, cafodd hyd i’r hyn a ymddangosai fel ronynnau trwchus mewn celloedd. Yn 1974, derbyniodd Wobr Nobel yn adran Ffisioleg a Meddygaeth[2] ynghyd ag Albert Claude a Christian de Duve.
Awgrmwyd y gair “ribosome” (Saesneg) gan Richard B. Roberts yn 1958[3], gan nad oedd “microsomal particles” yn ddigonol nac yn digon manwl, ac roedd “ribonuclearprotein particles of the microsome fraction” yn rhy hir-wyntog.
Tarddiad
[golygu | golygu cod]Credir bod y ribosom wedi dechrau fel strwythur syml a oedd a'r ddawn i hunan-gopio yn ystod y byd RNA[4]. Trwy ddefnyddio asidau amino datblygodd y gallu i greu protinau. Awgryma astudiaethau bod ribosomau wedi eu cyfansoddi o RNA yn unig (rRNA) wedi datblygu'r gallu i greu bondiau peptid. Mae tystiolaeth yn awgrymu yn gryf bod gan rRNA dibenion trosglwyddo gwybodaeth, manylion strwythurol a galluoedd catalytig.
Dosbarthiad Ribosomau
[golygu | golygu cod]
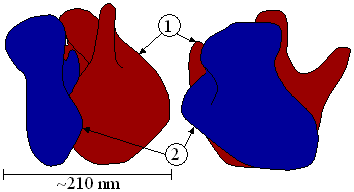
Mae gan ribosomau organebau'r tri pharth bywyd (Bacteria, Eukaryota ac Archaea) yr un cynllun sylfaenol ond mae rhai nodweddion sy’n unigol rhyngddynt.[5] Maent i gyd wedi ei wneud o un is-uned mawr ac un is-uned bach. Disgrifir y rhain yn ôl eu hymddygiad mewn allgyrchydd, mewn unedau Svedberg (S).[6] Yr uned yma sy'n disgrifio cyflymder (buanedd) gwaddodi gronyn mewn dŵr yn ôl y grym disgyrchiant sydd arno. Nid yw unedau Svedberg yn fesur o faint, fel y cyfryw, gan fod siâp, hefyd, yn dylanwadi arnynt.[7] Gweithreda ribosomau'r tri pharth bywyd yn yr un modd.[6] Mae'r ddwy is-uned yn cyfuno ac yn gweithio fel un i drosi gwybodaeth mRNA yn gadwyn polypeptid wrth adeiladu protein. Mae mRNA yn plygu am wddf yr uned fach ac yn symud trwyddo un codon ar y tro.[6] Mae tri safle rhwymo ar gyfer tRNA, sef safleoedd A (aminoacyl), P (peptidyl) ac E (allanfa).[6]
Procaryotig
[golygu | golygu cod]Mae ribosomau celloedd procaryotig[6] yn 70S, gydag is- uned fawr 50S ac is-uned bach 30S. Mae gan yr uned fawr màs moleciwlaidd o thua 1,500,000 Dalton (Da). Mae ynddo 33 protein gwahanol. Mae hefyd cadwyn rRNA 23S gyda thua 2,900 o niwcleotidau a chadwyn rRNA 5S gyda thua 120 o niwcleotidau. Mae gan yr uned fach mas moleciwlaidd o thua 800,000 Da. Mae ynddo 20 o broteinau gwahanol a chadwyn rRNA 16S gyda thua 1,600 o niwcleotidau.
Ewcaryotig
[golygu | golygu cod]Mae ribosomau celloedd ewcaryotig yn fwy ac yn fwy cymhleth. Maent yn 80S ac, eto, wedi'u gwneud o ddwy is-uned.[6] Mae’r is-uned fawr (60S) wedi ei wneud o 3 moleciwl rRNA (25S, 5.8S a 5S) a 46 o broteinau.[8] Mae’r is-uned fach (40S) wedi ei wneud o un gadwyn rRNA 18S a 33 o broteinau.[8] Am 79 o'r proteinau nid oes homolog yn strwythurau crisial ribosomau bacteria; nac yn yr archaea am 32 ohonynt.[9] Mae modd i'r proteinau sydd â homologau cario ehangiadau o asidau amino i'w cadwyni polypeptid sy’n sbesiffig i ewcaryotau.[9]
Archaea
[golygu | golygu cod]Mae gan ribosomau archaea[10] maint a chyfansoddiad tebyg i rai bacteria gyda is-unedau 30S a 50S a strwythur cyfansymiol 70S. Serch hynny, mae strwythur cynradd rRNA a ribosomau archaea yn debycach rai'r ewcaryota nag ydynt i rai procaryota. Nid oes unrhyw broteinau sydd yn gyffredin rhwng bacteria ac archaea yn unig. Mae unrhyw brotein sy’n bresennol mewn bacteria ac archaea hefyd yn bresennol mewn ribosomau ewcaryotig. Mae’r ribosom wedi ei wneud o dri moleciwl RNA (16S, 23S a 5S) a 50-70 brotein, yn dibynnu ar y rhywogaeth. Mae gan ribosomau archaea cyfansoddiad protein heterogenaidd. Mae gan archaea cynnar (Crenarcheota) ribosomau mwy cyfoethog mewn protein. Mae rhywogaethau hwyrach megis Halobacteriales a Thermoplasmatales yn tueddu i gael ribosomau a llai o brotein ynddynt.
Mae gan archaea extremoffilig addasiadau penodol i amodau amgylcheddol eithafol. Yn gyffredinol mae strwythur eu ribosomau yn fwy anhyblyg na ribosomau mesoffilig. Organeb mesoffilig yw organeb sy’n tyfu gorau mewn amodau cymedrol. Mae’r strwythur cadarn yma yn gwneud y ribosomau yn addas iawn ar gyfer arbrofion grisialu. Mae strwythurau 3D wedi'u datrys trwy ddefnyddio crisialau ribosom o archaea thermoffilig a haloffilig. Mae ribosomau organebau haloffilig yn cynyddu eu cynhwysedd hydradu trwy gynnwys proteinau ribosom asidig yn lle basig.
Strwythur Manwl
[golygu | golygu cod]Cafwyd sawl ymdrech i ddatrys manylion strwythur y ribosom.
Cyfrannodd Ada Yonath, ynghyd â gwyddonwyr eraill, at ddeall strwythur is-uned ribosom 50S yn ystod yr 80au a 90au. Yn y diwedd, lwyddwyd crisialu ribosom yr haloffil Halobacterium marismortui.[10][11] Yn hyn o beth, Steitz a'i gyd-weithwyr oedd y gyntaf i ddatrys y broblem gydwedd (phase).[6][12] Y broblem gydwedd yw'r golled gwybodaeth wrth wneud mesuriad yn ystod grisialograffaeth pelydr-x. Gwnaeth y broblem gydwedd hi’n anodd ddatrys union strwythur yr is-uned 50S.[6][12]
Amlygodd ymchwil pellach gan Nissen et al. yn 2000 [13] nad proteinau ribosom sy'n gyfrifol am actifedd transferas-peptidyl. Yn annisgwyl, yr rRNA sy'n gyfrifol. Transferas-peptidyl yw lleoliad catalysis ffurfio bondiau peptid. Mae ei safle actif wedi ei wneud o RNA yn unig.[13] Nid oes cadwyni ochr protein yn agosach na 18 Å i’r bond sy’n cael ei ffurfio.[13] Yn 1992, ystyriwyd hyn yn dystiolaeth i'r ddamcaniaeth fod ribosomau yn cynnwys ribosymau. Ribosymau yw ensymau sydd yn cael ei dawn gatalytig o RNA yn hytrach na protein.[14] Mae i'r darganfyddiad hwn oblygiadau i hanes cynnar datblygiad bywyd.[15]
Yn 2000, datryswyd strwythur is-uned 50S at gydraniad atomig am y tro cyntaf gyda strwythur is-uned H. marismortui.[12] Yn ogystal â hyn datryswyd strwythur is-uned 30S Thermus thermophilius.[16]
Yn 2011 datryswyd strwythur llawn cyntaf ribosom ewcaryotig o’r burum Saccharomyces cerevisiae trwy risialograffaeth.[8] Datgelodd y cynllun rhyngweithiad elfennau sbesiffig i ewcaryotau.[8] Cafodd model cyflawn o strwythur yr is-uned 40S ei greu o Tetrahymena thermophilia.[17] Yn ogystal â hyn, datryswyd is-uned 60S o T. thermophilia mewn cymhlygyn ag elF6.[18]
Lleoliad y Ribosom
[golygu | golygu cod]Ceir hyd i ribosomau ewcaryotig mewn dau leoliad. Maent naill ai ynghlwm wrth bilen neu yn rhydd yn y cytosol. Mae’r ddwy boblogaeth yma ar wahan ac mae iddynt swyddogaethau gwahanol. Yr is–unedau ribosom unigol, yn hytrach na'r ribosom cyfan, sy'n symud ar hap rhwng y boblogaeth mRNA.[1] Daw'r is-unedau ynghyd â'r mRNA i greu protein. Ar ôl i ribosom orffen adeiladu un polypeptid mae’r ddwy is-uned yn gwahanu a naill ai fe'u hail-ddefnyddid neu fe'i dadfeilid.[2]
Ar bilen
[golygu | golygu cod]Mae un boblogaeth o ribosom ynghlwm yn uniongyrchol i’r reticwlwm endoplasmig wrth adeiladu'r proteinau.[19][20] Oherwydd eu gwedd mewn delweddau microsgop electron, disgrifir y parthau yma yn reticwlwm endoplasmig garw. Mae’r ribosomau yma yn adeiladu proteinau y trosglwyddid i fatrics (sef cynnwys fesicl) y reticwlwm endoplasmig, neu a ddaw'n rhan o'r bilen ei hun. Mae rhan flaen yr mRNA yn cynnwys Dilyniant Signal reticwlwm endoplasmig sy'n cyfeirio’r ribosom i’r reticwlwm endoplasmig garw. Gan fod modd i nifer o ribosomau lynu wrth un moleciwl o mRNA fel arfer mae polyribosom yn ffurfio ac yn glynu wrth bilen y reticwlwm endoplasmig garw. Mae’r ribosomau unigol yn gallu dychwelyd yn ôl i’r cytosol ar ôl gorffen trosiad ond delir yr mRNA yn ei le gan weddill newidiol poblogaeth y ribosomau.
Yn rhydd yn y cytosol
[golygu | golygu cod]Ribosomau rhydd sy'n adeiladu’r holl broteinau eraill sydd wedi'u hamgodio (encoded) yn y genom.[19] Os nad oes Dilyniant Signal reticwlwm endoplasmig ar mRNA y protein erys y ribosom yn rhydd yn y cytosol ac mae’r cynnyrch yn cael ei rhyddhau i'r cytosol. Cytosol yw rhan y cytoplasm nad yw'n rhan o organynnau’r gell.
Trosiad
[golygu | golygu cod]
Gwneir proteinau yn y ribosom[21]. Mae’r ribosom ei hun wedi ei wneud o broteinau arbennig[22] ac asidau niwclëig. O’r ddwy is-uned sydd mewn ribosom, yr is-uned bach sydd yn datgodio'r côd er mwyn adeiladu proteinau drwy’r broses o drosiad (translation). Cynhelir y broses o drosiad yng nghytosol y gell ond gall, hefyd, gymerid lle ym mhilen y reticwlwm endoplasmig mewn celloedd ewcaryotig. Cyfarwyddiadau o'r mRNA sydd yn dethol yr asidau amino penodol a'u trefn yn y protein. Dyma'r broses o drosiad. (Megis trosi o "iaith" basau asidau niwclëig i "iaith" asidau amino protein.) Gall nifer o ribosomau glynu wrth un moleciwl mRNA i greu polysôm. Mae hyn yn caniatáu i un mRNA cynhyrchu nifer o folecylau o'r un protein ar y tro. Yn ystod trosiad, molecylau tRNA a ddefnyddir i drosglwyddo asidau amino i’r ribosom. Mae tRNA gwahanol ar gyfer pob un o’r 19 asid amino a'r un asid imino (prolin) sydd mewn proteinau. Mae’r asid amino penodol yn cysylltu â safle atodi ar y moleciwl tRNA sydd ar ei gyfer. Y broses hon yw cychwyniad (activation) ac mae angen egni ar ffurf ATP i‘w gychwyn. Mae gwrthgodon cyflenwol tRNA yn rhyngweithio a’r codon cyntaf weithredol ar yr mRNA. Wedyn mae’r ail godon yn atynnu i’r gwrthgodon cyflenwol nesaf ac yn y blaen hyd nes bod y cod cyfan wedi cael ei ddarllen a'i throsi. Mae codonau arbennig ar gyfer cychwyn (AUG fel arfer) a therfynu’r (UAG, UAA neu UGA) trosiad.
Cyfeiriadau
[golygu | golygu cod]- ↑ (Saesneg) Joachim Frank (2000) The ribosome — a macromolecular machine par excellence Chemistry & Biology 7, 133-141 [1][dolen marw]
- ↑ (Saesneg) https://www.nobelprize.org/nobel_prizes/medicine/laureates/1974/palade-facts.html
- ↑ (Saesneg) Roberts, R. B., editor. (1958) "Introduction" in Microsomal Particles and Protein Synthesis. New York: Pergamon Press, Inc. https://archive.org/stream/microsomalpartic00biop/microsomalpartic00biop_djvu.txt
- ↑ (Saesneg) George E. Fox (2010) Origin and Evolution of the Ribosome Cold Spring Harb Perspect Biol. 2, a003483. doi: 10.1101/cshperspect.a003483 http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2926754/
- ↑ (Saesneg) Londei, P. (2010). Archaeal Ribosomes. John Wiley & Sons Ltd, Chichester. doi: 10.1002/9780470015902.a0000293.pub2 http://www.els.net/WileyCDA/ElsArticle/refId-a0000293.html
- ↑ 6.0 6.1 6.2 6.3 6.4 6.5 6.6 6.7 (Saesneg)Structure and Function of the Ribosome. The Royal Swedish Academy of Sciences, 7th of October. Archifwyd 2016-04-09 yn y Peiriant Wayback.
- ↑ Slonczewski, J., Foster, J.W. (2009). Microbiology: An Evolving Science. New York: W.W. Norton.
- ↑ 8.0 8.1 8.2 8.3 (Saesneg) Ben-Shem, A., Garreau de Loubresse, N., Melnikov, S., Yusupova, G. & Yusupov, M. (2011). The Structure of the Eukaryotic Ribosome at 3.0 Å Resolution. Science, 334, 1524-1529. http://www.ncbi.nlm.nih.gov/pubmed/22096102
- ↑ 9.0 9.1 (Saesneg) Lecompte, O., Ripp, R., Thierry, J.C., Moras, D. & Poch, O. (2002). Comparative analysis of ribosomal proteins in complete genomes: an example of reductive evolution at the domain scale. Nucleic Acids Research, 24 (3), 5382-5390. http://www.ncbi.nlm.nih.gov/pubmed/12490706
- ↑ 10.0 10.1 (Saesneg) Shevack, A., Gewitz, H.S., Hennemann, B., Yonath, A., and Wittmann, H.G. (1985). Characterization and crystallization of ribosomal particles from Halobacterium marismortui. Federation of European Biochemical Societies Letters, 184, 68-71. http://www.sciencedirect.com/science/article/pii/0014579385806554
- ↑ (Saesneg) von Bohlen, K., Makowski, I., Hansen, H.A., Bartels, H., Berkovitch-Yellin, Z., Zaytzev-Bashan, A., Meyer, S., Paulke, C., Franceschi, F. & Yonath, A. (1991). Characterization and preliminary attempts for derivatization of crystals of large ribosomal subunits from Haloarcula marismortui diffracting to 3 A resolution. Journal of Molecular Biology, 222, 11-15. http://www.ncbi.nlm.nih.gov/pubmed/1942063
- ↑ 12.0 12.1 12.2 (Saesneg) Ban, N., Nissen, P., Hansen, J., Moore, P.B., Steitz, T.A. (2000). The Complete Atomic Structure of the Large Ribosomal Subunit at 2.4 Å Resolution. Science, 289, 905-920. http://www.ncbi.nlm.nih.gov/pubmed/10937989
- ↑ 13.0 13.1 13.2 (Saesneg) Nissen, P., Hansen, J., Ban, N., Moore, P.B., and Steitz, T.A. (2000). The structural basis of ribosome activity in peptide bond synthesis. Science, 289, 920-930. http://www.ncbi.nlm.nih.gov/pubmed/10937990
- ↑ (Saesneg) Noller, H.F., Hoffarth, V., and Zimniak, L. (1992). Unusual resistance of peptidyl transferase to protein extraction procedures. Science, 256, 1416-1419. http://www.ncbi.nlm.nih.gov/pubmed/1604315
- ↑ (Saesneg) Michael P Robertson & Gerald F Joyce (2010) The Origins of the RNA World. Cold Spring Harbor Perspectives in Biology (ar lein) http://cshperspectives.cshlp.org/content/4/5/a003608.full doi: 10.1101/cshperspect.a003608
- ↑ (Saesneg) Schluenzen, F., Tocilj, A., Zarivach, R., Harms, J., Gluehmann, M., Janell, D., Bashan, A., Bartels, H., Agmon, I. Franceschi, F and Yonath, A. (2000). Structure of Functionally Activated Small Ribosomal Subunit at 3.3 Å Resolution. Science, 102, 615-623. http://www.sciencedirect.com/science/article/pii/S0092867400000842
- ↑ (Saesneg) Rabl, J., Leibundgut, M., Ataide, S.F., Haag, A. & Ban, N. (2011). Crystal Structure of the Eukaryotic 40S Ribosomal Subunit in Complex with Initiation Factor 1. Science, 331, 730-736. http://www.ncbi.nlm.nih.gov/pubmed/21205638
- ↑ (Saesneg) Klinge, S., Voigts-Hoffmann, F., Leibundgut, M., Arpagaus, S. & Ban, N. (2011). Crystal Structure of the Eukaryotic 60S Ribosomal Subunit in Complex with Initiation Factor 6. Science, 334, 941-948. http://www.ncbi.nlm.nih.gov/pubmed/22052974
- ↑ 19.0 19.1 (Saesneg) Alberts, B., Johnson, A., Lewis, J., Raff, M., Roberts, K. & Walter, P. Molecular Biology of the Cell 4th edition. 2002. New York: Garland Science. The Endoplasmic Reticulum. http://www.ncbi.nlm.nih.gov/books/NBK26841/
- ↑ (Saesneg) British Society for Cell Biology. Ribosome. [2]>
- ↑ (Saesneg) V. Ramakrishnan (2002) Ribosome Structure and the Mechanism of Translation. Cell 108, 557–572 //http://www.sciencedirect.com/science/article/pii/S0092867402006190
- ↑ (Saesneg) Korobeinikova AV, Garber MB & Gongadze GM (2012) Ribosomal proteins: structure, function, and evolution. Biochemistry (Mosc) 77, 562-74. doi: 10.1134/S0006297912060028. http://www.ncbi.nlm.nih.gov/pubmed/22817455
