Isomeredd geometrig
Lle ceir bondiau sengl, gall un rhan o'r moleciwl cylchdroi mewn perthynas â gweddill y moleciwl. Mae bondiau dwbl yn atal y cylchdroi rhydd a dyma sy'n esbonio bodolaeth isomerau geometrig. Moleciwlau sydd a'r un fformiwlau molecylaidd a'r un fformiwla adeiladol ond a geometregau gwahanol i'w gilydd i'w isomerau geometrig. Gall alcennau sydd a bond dwbl dangos isomeredd geometrig oherwydd y bond dwbl.
Nodiant E-Z[golygu | golygu cod]
Nodiant E-Z neu gonfensiwn E-Z ydy dull dethol IUPAC o ddisgrifio stereocemeg bondiau dwbwl sydd a 3 neu 4 dirprwy. Ble mae yna fondiau sengl cofalent, gall rhan o'r moleciwl gylchdroi. Mae hyn yn estyniad o'r nodiant cis/trans.
Yn yr animeiddiad uchod, dangosir Ethan sydd efo bond sengl sy'n galluogi cylchdroi. Mae'r bondiau dwbl yma yn atal y cylchdroi a dyma sy'n creu'r theori E-Z. Mae gan y moleciwlau hyn yr un fformiwla foleciwlaidd ond adeileddau gwahanol.

- Mae ffurfwedd E (o’r gair Almaeneg "entgegen" sy'n golygu "gwrthwyneb") yn digwydd os yw'r ddau grŵp o flaenoriaeth uchel ar ochrau cyferbyniol.
- Mae ffurfwedd Z (o’r gair Almaeneg "zusammen" sy'n golygu "ynghyd") yn digwydd os os yw'r ddau grŵp o flaenoriaeth uchel ar yr un ochor.

|
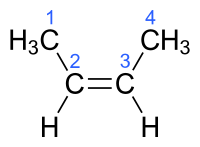
| |
| (E)-But-2-ene- Berwbwynt Fwy |
(Z)-But-2-ene Berwbwynt Llai |
Mae'r isomerau yma'n dangos rhai gwahaniaethau mewn priodweddau ffisegol. Mae gan isomerau E berwbwyntiau uwch nag isomerau Z. Mae yna rhai gwahaniaethau mewn priodweddau cemegol yn dibynnu ar yr adwaith.
